Dear colleagues,
I hope you all enjoyed your summer holidays! Allow me to deliver my usual monthly update of the most important regulatory news in the medical device industry for Russia, the Eurasian Economic Union (EEU), and the CIS region:
- Possible expansion of restrictions on state procurement for foreign manufacturers of medical devices.
In August 2015, the Russian Ministry of Industry and Trade (Minpromtorg) proposed the introduction of a new set of restrictions on the state and municipal procurement of imported medical devices. A new legal initiative proposes to considerably expand the list ‘of certain types of medical devices originating from foreign countries subject to restrictions for state and municipal procurements in the Russian Federation’ adopted in February 2015 by way of Decree #102 (link in Russian) which has already imposed a ban on applications to tender for state and municipal procurements for foreign manufacturers of 45 types of medical devices, provided there are two or more entries from manufacturers in Russia, Belarus, Armenia, and Kazakhstan.
The draft of the new initiative, which was published (link in Russian) on the 3rd of August 2015, generated active discussions and an unsought avalanche of attention from the Russian medical device industry as well as non-governmental organisations. “Public discussions” concerning the draft will continue until the 1st of October 2015.
State procurement restrictions may affect antiseptics, disinfectants, medical dressings, some orthopaedic and rehabilitation equipment, condoms, artificial heart valves, defibrillators, dental and endodontic instruments, certain types of ultrasound and X-ray equipment, and some other medical devices. In addition to the 45 medical devices affected in February, there are now more than 90 types of medical devices under discussion.
One should recall that the key strategic objective for Minpromtorg is ‘40% of medical devices for state procurements to be manufactured within Russia till 2020’.
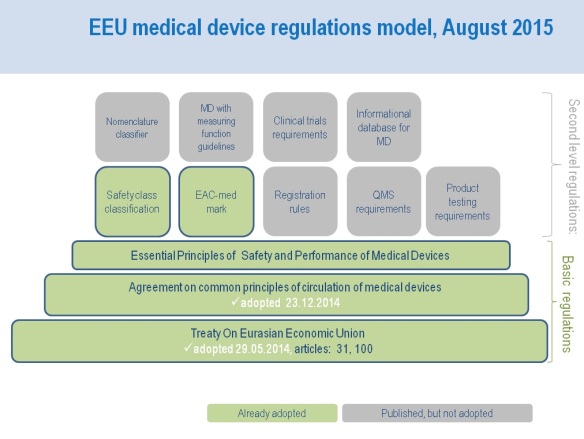
- Harmonised Eurasian regulations for medical devices – four months to go.
The Eurasian Commission published a new series of “second level” guidelines concerning anagreement on common principles and rules of circulation of medical devices in the Eurasian Economic Union (EEU).
In August 2015, drafts of the following documents became available:
- Common Eurasian rules on safety and vigilance monitoring of medical devices (link in Russian).
- Eurasian rules for medical devices with measuring function (link in Russian).
- Common Eurasian nomenclature for medical devices (link in Russian).
- Guidance for conducting clinical trials for medical devices in EEU (link in Russian).
- Rules for the common Eurasian informational database for medical devices (link in Russian).
- Common Eurasian requirements on quality management system for medical device manufacturers (link in Russian).
The Eurasian Commission is expected to approve these drafts by the end of September 2015. All approved documents on the Eurasian medical device integration initiative can be found on the official website of the Eurasian Commission.
It is expected that the new medical device regulation system will come into effect in Russia, Kazakhstan, and Belarus on the 1st of January 2016. In these countries, the new system will overhaul regulation approaches for all stages of the medical device lifecycle.
- Update on regulations of narcotic substances for medical products
On the 8th of August 2015, the Russian Ministry of Health enforced amendments for the decree #157n (link in Russian) ‘On approval of the maximum allowable amount of narcotic drugs, psychotropic substances and their precursors, contained in medical products’. This decree regulates the maximum amount of such substances permitted per 1 mL of pharmaceutical product or medical device. This may be pertinent to some IVD and dental adhesive materials. The updated and finalised list of substances can be found by following the link in Russian.
*****
The objective of this blog is to clarify Russian and Eurasian medical device regulations. Please post your comments and questions here or on the Russian medical device regulations LinkedIn group Feel free to follow me on twitter @MedDevRus.
